El titanio y sus aleaciones se han convertido en la piedra angular de la restauración moderna de implantes dentales debido a su excelente biocompatibilidad, propiedades mecánicas y capacidad de osteointegración. Este artículo describe sistemáticamente la clasificación de los materiales de titanio, sus propiedades fundamentales, su amplia aplicación en el campo de la odontología (centrándose en los implantes), las tecnologías de procesamiento y su impacto, los retos actuales y las perspectivas, como las nuevas aleaciones, la fabricación aditiva y la nanoingeniería de superficies, con el objetivo de proporcionar referencias teóricas para la práctica clínica y la investigación.

1. Introducción
El titanio (Ti), vigésimo segundo elemento de la tabla periódica, es un metal de transición de color blanco plateado. Desde que en la década de 1950 el erudito sueco Per-Ingvar Brånemark descubriera que el titanio podía formar una conexión directa, funcional y estructural con el tejido óseo (lo que se conoce como "osteointegración"), el titanio ha abierto un brillante capítulo en el campo biomédico, especialmente en la implantología dental. Su combinación única de propiedades cumple a la perfección los rigurosos requisitos de los materiales de rehabilitación oral: excelente biocompatibilidad para evitar el rechazo, resistencia específica extremadamente alta para soportar las fuerzas masticatorias, extraordinaria resistencia a la corrosión frente a la erosión de la saliva y buena osteoconductividad para garantizar la estabilidad a largo plazo. El éxito y la previsibilidad de los tratamientos con implantes dentales dependen en gran medida de estas características fundamentales del titanio, que lo convierten en el "rey de los biomateriales" insustituible en las restauraciones dentales, especialmente para la rehabilitación de la pérdida de dientes.
2. Clasificación del titanio y las aleaciones de titanio
Los materiales de titanio utilizados en odontología pueden clasificarse en dos categorías principales en función de su composición y propiedades:
- 2.1 Titanio comercialmente puro (CP Ti):
- Según las normas ASTM (por ejemplo, F67), el Ti CP se divide en los grados 1 a 4 en función del contenido de elementos intersticiales como el oxígeno y el hierro.
- Características: Ofrece la mejor biocompatibilidad (es el más inerte), una excelente resistencia a la corrosión y una buena plasticidad, lo que facilita su transformación. Sin embargo, su resistencia (especialmente a la fluencia y a la fatiga) es relativamente baja.
- Aplicaciones dentales: Se utiliza principalmente para implantes, pilares, estructuras de coronas y puentes y brackets de ortodoncia cuando las exigencias de resistencia no son extremas. El CP Ti Grado 4 es el más utilizado.
- 2.2 Aleaciones de titanio:
- Mediante la adición de elementos de aleación (por ejemplo, Al, V, Nb, Zr, Mo, Ta), se mejoran las propiedades mecánicas del titanio.
- Aleación representativa - Ti-6Al-4V (Grado 5):
- La clásica aleación de titanio de fase α+β (el aluminio 6% estabiliza la fase α, el vanadio 4% estabiliza la fase β).
- Características: Mucho más resistente que el Ti CP (aproximadamente el doble que el Ti CP Grado 4), excelentes propiedades a la fatiga y buena resistencia a la corrosión. Sin embargo, existe preocupación por la posible toxicidad biológica del vanadio (V) y el aluminio (Al) (a pesar de las escasas pruebas clínicas), y su módulo elástico sigue siendo superior al del hueso.
- Otras aleaciones nuevas/específicas para odontología:
- Ti-6Al-7Nb, Ti-5Al-2,5Fe: Diseñado para sustituir al Ti-6Al-4V, evitando el vanadio para una mejor biocompatibilidad.
- Aleaciones de titanio tipo β (por ejemplo, Ti-13Nb-13Zr, Ti-12Mo-6Zr-2Fe - TMZF, Ti-35Nb-7Zr-5Ta): Utilizan niobio (Nb), tántalo (Ta), circonio (Zr) y molibdeno (Mo) como principales elementos de aleación.
- Características: Menor módulo elástico (más próximo al hueso, lo que reduce el blindaje contra las tensiones), mayor resistencia a la fatiga y tenacidad a la fractura, excelente resistencia a la corrosión, ausencia de elementos controvertidos (como el V y el Al) y biocompatibilidad superior. En la actualidad son un punto caliente de la investigación.
- Aleaciones Ti-Zr (por ejemplo, Roxolid® - Ti-15Zr): Desarrollado específicamente para odontología, ofrece mayor resistencia que el Ti CP y se aproxima a la del Ti-6Al-4V, pero con una biocompatibilidad más cercana a la del titanio puro y un módulo elástico moderado. Especialmente indicado para implantes de pequeño diámetro.
Tabla 1: Comparación de las propiedades del titanio dental común y de las aleaciones de titanio
| Tipo de material | Grado típico | Composición principal | Ventajas | Limitaciones | Principales aplicaciones dentales |
|---|---|---|---|---|---|
| Ti comercialmente puro | Grado 1 | >99% Ti | La mejor biocompatibilidad, excelente resistencia a la corrosión, dúctil | Resistencia más baja | Piezas de paredes finas, membranas |
| Grado 2 | >98,9% Ti | Buen rendimiento general (equilibrio entre biocompatibilidad, resistencia a la corrosión, solidez y plasticidad) | Resistencia moderada | Pilares, pequeñas restauraciones, brackets | |
| Grado 3 | >98,8% Ti | Mayor resistencia que el Grado 2 | Ligeramente menos dúctil que el Grado 2 | Implantes (algunos), pilares, estructuras | |
| Grado 4 | >98,6% Ti | CP Ti más fuerte | Menor ductilidad que el CP Ti de grado inferior | Principales implantes, pilares y arcos de alambre | |
| α+β Aleaciones de titanio | Ti-6Al-4V (Gr5) | Ti-6Al-4V | Alta resistencia, excelente resistencia a la fatiga | Contiene Al/V (potencial biotoxicidad), alto módulo elástico | Implantes en zonas de alta carga, conectores, herramientas quirúrgicas |
| Ti-6Al-7Nb | Ti-6Al-7Nb | Resistencia cercana a Gr5, sin V (mejor biocompatibilidad) | Contiene Al | Implantes (sustituto Gr5) | |
| Aleaciones de tipo β | Ti-13Nb-13Zr | Ti-13Nb-13Zr | Bajo módulo elástico, excelente biocompatibilidad, sin Al/V | Tratamiento complejo | Implantes (para mitigar el blindaje contra la tensión), alambres de ortodoncia |
| Ti-12Mo-6Zr-2Fe (TMZF) | Ti-12Mo-6Zr-2Fe | Bajo módulo elástico, alta resistencia, buena resistencia a la corrosión | Contiene Fe (datos biológicos limitados a largo plazo) | Implantes, implantes ortopédicos | |
| Aleación dental específica | Ti-15Zr (Roxolid®) | Ti-15Zr | Mucho más resistente que el CP4, cercano al Gr5, biocompatibilidad cercana al CP Ti | Mayor coste | Implantes de diámetro pequeño/cresta estrecha |
(Nota: Esta tabla es una comparación simplificada. Los parámetros exactos de rendimiento deben consultarse en las normas de materiales y los datos del fabricante. Módulo elástico: CP Ti ~100-110 GPa, Ti-6Al-4V ~110-115 GPa, aleaciones β ~55-85 GPa, hueso cortical ~10-30 GPa)
3. Principales ventajas del titanio en odontología
El titanio y sus aleaciones presentan ventajas incomparables en las aplicaciones dentales:
- 3.1 Biocompatibilidad y resistencia a la corrosión excepcionales:
- Biocompatibilidad: El titanio puede formar espontáneamente una película pasiva de dióxido de titanio (TiO₂) densa, estable e inerte en entornos fisiológicos. Esta película aísla eficazmente la liberación de iones metálicos en los tejidos circundantes, minimizando la inflamación y el rechazo inmunitario, un requisito previo para la osteointegración. Numerosos estudios clínicos y datos de seguimiento a largo plazo confirman la excelente respuesta de los tejidos a los implantes de titanio.
- Resistencia a la corrosión: La capa pasiva de TiO₂ es muy resistente a los fluidos corporales (saliva, sangre, líquido intersticial), los fluoruros (de la pasta dentífrica y el enjuague bucal) y las fluctuaciones del pH oral (por ejemplo, de los alimentos y bebidas ácidos). Incluso durante el servicio a largo plazo, los problemas como las picaduras, la corrosión por intersticios o el agrietamiento por corrosión bajo tensión son extremadamente raros, lo que garantiza la estabilidad química a largo plazo y la seguridad de los implantes en el duro entorno bucal.
- 3.2 Alta relación resistencia/peso (alta resistencia específica):
El titanio tiene una densidad significativamente menor (~4,5 g/cm³) que el acero inoxidable (~8 g/cm³) y las aleaciones de cobalto-cromo (~8,5 g/cm³), pero su resistencia (especialmente la de las aleaciones de titanio) es comparable o incluso superior a la de estos materiales. Esto significa que las restauraciones o implantes de titanio pueden proporcionar una capacidad de carga suficiente (soportar fuerzas masticatorias, normalmente de hasta varios cientos de newtons) al tiempo que son más ligeros, reduciendo así la carga sobre los tejidos de soporte y mejorando la comodidad del paciente. - 3.3 Excelente capacidad de osteointegración:
Esta es la principal ventaja del titanio como material de implante. La capa de TiO₂ de la superficie del titanio es bioactiva y puede adsorber selectivamente proteínas de la sangre y los fluidos corporales (como el fibrinógeno y la fibronectina), favoreciendo la adhesión, proliferación y diferenciación de los osteoblastos. Finalmente, el nuevo tejido óseo puede depositarse directamente y adherirse firmemente a la superficie de titanio, formando una conexión estructural y funcional directa sin una interfaz de tejido conectivo fibroso. Esta integración directa hueso-implante proporciona la base biológica para la retención estable a largo plazo del implante. - 3.4 Radiolucencia y ventajas estéticas:
Radiolucencia: El titanio tiene una atenuación de los rayos X mucho menor que los metales tradicionales, como las aleaciones de oro y las aleaciones de cobalto-cromo. En las radiografías (películas periapicales, panorámicas, CBCT), los implantes de titanio aparecen como imágenes de densidad relativamente baja, lo que permite una visualización clara de la estructura ósea circundante. Esto facilita a los clínicos la evaluación precisa del estado de osteointegración, los cambios del nivel óseo marginal y la salud periimplantaria, por lo que resulta clave para el seguimiento a largo plazo.
Ventaja estética: En el caso de encías finas o implantes colocados superficialmente (especialmente en la zona anterior), los pilares metálicos tradicionales (p. ej., aleaciones de oro) pueden causar una decoloración grisácea a través de la encía, afectando a la estética. Aunque los pilares de titanio pueden plantear un riesgo similar, su tono gris es generalmente más claro y puede evitarse por completo seleccionando pilares totalmente cerámicos o pilares de titanio con recubrimientos de cerámica o circonio. Como material para pilares o estructuras, el titanio también proporciona un soporte fiable para restauraciones totalmente cerámicas, lo que permite obtener resultados estéticos de aspecto natural.

4. Aplicaciones comunes del titanio en odontología
El titanio se utiliza ampliamente en diversos campos de la restauración dental, la implantación, la ortodoncia y la cirugía:
4.1 Implantes dentales:
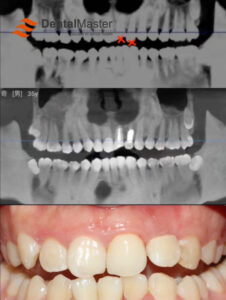
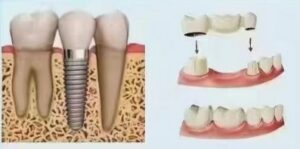
Se trata de la aplicación más central y exitosa del titanio en odontología. Implantes de titanio sirven como raíces dentales artificiales, insertadas quirúrgicamente en el hueso maxilar para soportar superestructuras (coronas, puentes, sobredentaduras). Sus diseños (en forma de raíz, cilíndricos, en forma de lámina), tratamientos superficiales (SLA, SLActive, anodización, etc.) y métodos de conexión (hexagonal interno, cono Morse, cambio de plataforma) siguen evolucionando para satisfacer diversas condiciones óseas, necesidades protésicas y demandas estéticas. La tasa de éxito a largo plazo (más de 10 años) suele superar los 95% bajo indicaciones estrictas.
4.2 Pilares y componentes protésicos:
Pilares: Los componentes clave que conectan la plataforma del implante con la superestructura. Pueden ser de titanio (CP Ti o aleación), circonio o una combinación (base de titanio + parte superior de circonio). Pilares de titanio son resistentes, fiables en conexión con los implantes y biocompatibles, lo que los convierte en una elección mayoritaria, especialmente adecuada para regiones posteriores o pilares angulados.
Tornillos protésicos: Se utilizan para fijar pilares o restauraciones a implantes, normalmente fabricados con aleaciones de titanio de alta resistencia (por ejemplo, Ti-6Al-4V). Requieren una resistencia a la fatiga y una precisión dimensional extremadamente altas.
Mangas, conectores: En estructuras protésicas complejas (como las sobredentaduras retenidas por barra), los conectores de titanio proporcionan estabilidad y resistencia.
4.3 Arcos y brackets de ortodoncia:
Arcos: Las aleaciones de titanio beta (por ejemplo, TMA - aleación de titanio y molibdeno) son las preferidas en ortodoncia fija debido a su menor módulo elástico (fuerzas más suaves y continuas), alto límite elástico (gran rango de deformación), buena conformabilidad y biocompatibilidad. Suelen utilizarse en las últimas fases para ajustes finos.
Soportes: Los brackets metálicos de titanio se utilizan principalmente en pacientes alérgicos al níquel, ya que ofrecen una buena biocompatibilidad y suficiente resistencia.
4.4 Herramientas e instrumentos quirúrgicos:
La excelente resistencia, ligereza y resistencia a la corrosión del titanio lo convierten en el material ideal para fabricar productos duraderos de alta precisión. instrumentos quirúrgicos dentalesComo guías quirúrgicas para implantes, osteotomos, portaagujas, retractores y portaimplantes/llaves. Su naturaleza no magnética también se adapta a entornos de examen especiales (por ejemplo, resonancia magnética).
4.5 Coronas, puentes y estructuras (estructuras de prótesis):
Crown/Bridge Frameworks: El titanio comercialmente puro (principalmente los grados 1 y 2) puede fundirse o fresarse mediante CAD/CAM para fabricar coronas o puentes. Entre sus ventajas figuran su ligereza, buena biocompatibilidad y radiotransparencia. Las desventajas incluyen las dificultades de colado (oxidación, contracción) y una estética inferior a la de la cerámica sin metal (se necesita porcelana de recubrimiento, y la adhesión al titanio es un reto clave).
Estructuras de prótesis removibles: En comparación con las aleaciones tradicionales de cobalto-cromo, las estructuras de titanio reducen significativamente el peso, mejoran la comodidad de uso, aumentan la biocompatibilidad, tienen menos impacto sobre el gusto y no plantean problemas de alergia. Se utilizan habitualmente en bases y cierres de prótesis removibles parciales.

5. Procesado y tratamiento superficial del titanio: La clave para mejorar el rendimiento
El rendimiento del titanio no sólo depende de sus propiedades inherentes, sino también en gran medida de sus métodos de procesamiento y del estado de su superficie, especialmente crucial para la osteointegración del implante.
5.1 Técnicas de tratamiento:
Trabajo en frío: Como el laminado y el estirado, utilizados para producir alambres (arcos de ortodoncia), láminas (estructuras) y barras (pilares mecanizados) de titanio, implantes en bruto). Aumenta la resistencia pero reduce la ductilidad.
Mecanizado (fabricación sustractiva): Principal método de fabricación de implantes, pilares y componentes protésicos personalizados. Requiere máquinas de alta rigidez, herramientas especializadas (de carburo, diamantadas) y refrigerante (que evite estrictamente la oxidación). Se necesita una precisión extremadamente alta (nivel de micras), con costes relativamente elevados. La tecnología CAD/CAM se aplica ampliamente en este campo para una personalización eficaz y de alta precisión.
Reparto: Se utiliza para fabricar estructuras de coronas/puentes y dentaduras postizas. Debe realizarse en entornos de vacío o gas inerte (argón) para evitar la oxidación y la absorción de gases (hidrógeno, oxígeno). Las piezas fundidas suelen presentar contracción, defectos internos y capas de reacción superficial (α-case), lo que requiere un tratamiento posterior (chorro de arena, grabado ácido, prensado isostático en caliente - HIP) para mejorar el rendimiento.
Fabricación aditiva (impresión 3D): Técnicas como la fusión selectiva por láser (SLM) y la fusión por haz de electrones (EBM) permiten fabricar piezas complejas de titanio (pilares personalizados, estructuras, guías quirúrgicas, implantes porosos) directamente a partir de modelos digitales en 3D. Estos métodos ofrecen una gran libertad de diseño, un uso eficiente del material y la posibilidad de crear estructuras internas complejas (por ejemplo, estructuras porosas biomiméticas para el crecimiento óseo). Se trata de una de las principales direcciones de desarrollo futuro (para más detalles, véase la sección 7).
5.2 Tecnologías de modificación de superficies:
La morfología a micro y nanoescala, la composición química y la humectabilidad (hidrofilicidad) de la superficie del implante tienen un impacto decisivo en la adsorción de proteínas, el comportamiento celular (adhesión, proliferación, diferenciación) y la velocidad y calidad finales de la osteointegración. Entre las principales tecnologías figuran:
Tratamientos mecánicos:
- Mecanizado/Rectificado: Forma superficies lisas o de textura regular. Utilizado con frecuencia en las primeras aplicaciones, ahora se aplica principalmente en la región del cuello del implante (para reducir la adhesión de placa).
- Granallado/arenado: Las superficies se bombardean con alúmina (Al₂O₃), dióxido de titanio (TiO₂) o partículas cerámicas biocompatibles (como la hidroxiapatita, HA) para crear rugosidades macroscópicas (a escala micrométrica), aumentando la superficie y la capacidad de enclavamiento mecánico. A menudo se combina con el grabado ácido.
Tratamientos químicos:
- Grabado al ácido: Utiliza ácidos fuertes (como la mezcla de HCl/H₂SO₄, HF/HNO₃) para disolver la superficie de titanio, formando una morfología porosa compleja a escala micrométrica o incluso nanométrica. Aumenta la superficie específica y mejora la humectabilidad. Forma la base de muchos tratamientos compuestos.
- Tratamiento térmico alcalino: El titanio se sumerge en una solución de NaOH y luego se calienta, formando una capa de gel de titanato de sodio en la superficie, que puede transformarse en apatita similar al hueso en los fluidos corporales, aumentando significativamente la bioactividad.
Tratamientos fisicoquímicos:
- Chorro de arena, grano grande, grabado al ácido (SLA®): En primer lugar, el chorro de arena crea una rugosidad a escala micrométrica, seguida de un grabado ácido para eliminar los residuos del chorro y añadir estructuras a nanoescala. Esta es actualmente una de las tecnologías de tratamiento de superficies con más éxito comercial, más utilizada y con mayor respaldo clínico, ya que acelera significativamente la osteointegración y mejora la estabilidad inicial.
- SLA hidrófilo (SLActive®): Tras el tratamiento SLA, las superficies se almacenan/envasan bajo protección de nitrógeno o en solución salina para mantener una elevada energía superficial e hidrofilicidad (ángulo de contacto cercano a 0°). Hidrofilicidad favorece en gran medida la rápida propagación de la sangre y los fluidos corporales sobre la superficie del implante, acelerando la formación de la matriz de fibrina y el reclutamiento de osteoblastos, con lo que se consigue una cicatrización ósea más rápida (semanas en lugar de meses en comparación con la SLA tradicional).
- Oxidación anódica: La aplicación de tensión en un electrolito permite el crecimiento controlado de una película gruesa y porosa de TiO₂ (que puede incluir elementos de calcio y fosfato) sobre la superficie de titanio. El grosor de la película (que afecta a la interferencia del color en los pilares estéticos), la porosidad y la composición pueden controlarse con precisión, mejorando la resistencia a la corrosión, la bioactividad y (en condiciones específicas) las propiedades antibacterianas.
Tecnologías de revestimiento:
- Recubrimiento de hidroxiapatita (HA): Depósito de una capa de cerámica de HA bioactiva sobre superficies de titanio mediante métodos como la pulverización de plasma (TPS). Su finalidad es proporcionar una interfaz directa osteoconductora/osteoinductora. Sin embargo, existen problemas relacionados con la adhesión del revestimiento y la estabilidad a largo plazo (posible degradación y delaminación), y su uso está menos extendido que el de SLA.
- Otros recubrimientos de moléculas bioactivas: Como las proteínas morfogenéticas óseas (BMP), los péptidos (RGD), los factores de crecimiento, etc., actualmente en fase de investigación, destinados a proporcionar señales biológicas más activas en la superficie.
5.3 Efectos de los tratamientos superficiales en las respuestas biológicas y el rendimiento clínico:
- Osteointegración acelerada: Las superficies rugosas (SLA, SLActive) y bioactivadas (recubrimiento de HA, tratamiento térmico alcalino) acortan significativamente el periodo de cicatrización del implante (de 3-6 meses en superficies lisas tradicionales a 3-6 semanas o incluso menos), lo que permite la carga inmediata o temprana y mejora la satisfacción del paciente.
- Bloqueo biomecánico mejorado: Las superficies rugosas a micro/nanoescala aumentan el área de contacto hueso-implante (BIC%) y forman estructuras mecánicas de enclavamiento, mejorando en gran medida la estabilidad inicial del implante y su capacidad de carga a largo plazo.
- Impacto en la fijación de los tejidos blandos: Las características superficiales (como la suavidad y la hidrofilia) de la parte transgingival (cuello) del implante son cruciales para la adhesión de células epiteliales y fibroblastos, formando un buen sellado del tejido blando (anchura biológica), que es clave para prevenir la invasión bacteriana y mantener la salud periimplantaria.
- Riesgos potenciales: Las superficies excesivamente rugosas o microfisuradas pueden aumentar el riesgo de colonización bacteriana, lo que exige normas de control más estrictas para la periimplantitis. La estabilidad a largo plazo de los recubrimientos (como el HA) sigue necesitando más pruebas.

6. Retos y limitaciones
Aunque el titanio ha cosechado grandes éxitos en odontología, aún quedan algunos retos por superar:
6.1 Costes de materias primas y transformación:
- La extracción y el refinado de minerales de titanio (rutilo, ilmenita) mediante los procesos Kroll o Hunter requieren mucha energía y son complejos, por lo que los costes de las materias primas son significativamente superiores a los del acero inoxidable o las aleaciones de cobalto-cromo.
- El procesamiento del titanio (fundición, mecanizado, impresión 3D) es difícil y requiere equipos especializados, estrictos controles ambientales (protección con gas inerte) y trabajadores altamente cualificados, lo que aumenta aún más los costes de fabricación. Esto hace que los productos dentales finales a base de titanio (especialmente implantes y restauraciones personalizadas) sean relativamente caros.
6.2 Alergias o sensibilidades raras:
- En general, se considera que el titanio es extremadamente poco alergénico. Sin embargo, casos clínicos raros pero documentados informan de hipersensibilidad de tipo retardado (reacción alérgica de tipo IV) en un número muy reducido de individuos al titanio metálico o a elementos de aleación (por ejemplo, aluminio, vanadio, impurezas de níquel).
- Los síntomas pueden incluir inflamación periimplantaria persistente, enrojecimiento e hinchazón de la mucosa, dolor e incluso fracaso de la osteointegración.
- El diagnóstico es difícil debido a la falta de pruebas estandarizadas de alergia al titanio altamente específicas y sensibles (por ejemplo, la interpretación de la prueba del parche es controvertida).
- Aunque la incidencia es muy baja (mucho menor que la alergia al níquel), el tratamiento de los pacientes sospechosos (por ejemplo, el cambio a implantes de circonio) y la investigación de mecanismos siguen siendo temas clínicos importantes.
6.3 Desgaste y corrosión electroquímica en entornos de metales mixtos:
- Fricción/Corrosión: Los sistemas de implantes incluyen múltiples interfaces metálicas (por ejemplo, tornillos del pilar y roscas internas del implante, conexiones pilar-implante). Los micromovimientos funcionales (fuerzas masticatorias, oclusión) provocan desgaste por frotamiento, que daña las películas protectoras de óxido y expone el metal fresco.
- Corrosión galvánica: Cuando existen metales diferentes en la cavidad bucal (por ejemplo, implantes de titanio + coronas de oro, alambres de ortodoncia de acero inoxidable + brackets de titanio) y están conectados por la saliva (electrolito), las diferencias de potencial provocan una disolución por corrosión acelerada del metal con el potencial más bajo (ánodo, por ejemplo, el titanio).
- Incluso los distintos grados o estados superficiales del titanio pueden presentar ligeras diferencias potenciales.
- Corrosión por grietas: En las conexiones metálicas bien ajustadas pero no absolutamente selladas (por ejemplo, la interfase pilar-implante), una concentración reducida de oxígeno, un pH más bajo y la acumulación de iones cloruro en las grietas pueden inducir una corrosión localizada.
- Consecuencias: Estos procesos de corrosión pueden debilitar la resistencia mecánica, liberar iones/partículas metálicas en los tejidos circundantes, lo que puede desencadenar reacciones locales o sistémicas (por ejemplo, alergia, inflamación), y afectar a la estabilidad y vida útil del implante a largo plazo. Las principales contramedidas son el control estricto de la compatibilidad de materiales, la optimización del diseño de las conexiones (por ejemplo, juntas cónicas Morse) y la mejora de la precisión de fabricación para reducir las micromovimientos.
7.Desarrollo futuro e innovación
Para superar los retos existentes y mejorar aún más el rendimiento, la investigación sobre materiales dentales a base de titanio se centra en las siguientes direcciones:
7.1 Desarrollo de nuevas aleaciones a base de titanio:
- Optimización de aleaciones sin aluminio ni vanadio: Seguir promoviendo y optimizando aleaciones alternativas como Ti-6Al-7Nb, y desarrollar en profundidad aleaciones de titanio de tipo β con prestaciones superiores y mejor biocompatibilidad (por ejemplo, aleaciones del sistema Ti-Nb-Zr-Ta). El objetivo es conseguir un módulo elástico ultrabajo próximo al del tejido óseo, límites de fatiga más elevados y una excelente resistencia a la corrosión.
- Aleaciones de titanio-circonio (Ti-Zr): Las aleaciones representadas por Roxolid® (Ti-15Zr) se han comercializado con éxito. Su resistencia (>850 MPa) es muy superior a la del titanio comercialmente puro (CP) (~550 MPa) y cercana a la del Ti-6Al-4V (~900 MPa), manteniendo al mismo tiempo una biocompatibilidad comparable a la del titanio puro y una excelente capacidad de osteointegración. En el futuro, habrá que optimizar el contenido de Zr, explorar aleaciones de Ti-Zr combinadas con otros elementos (como Nb, Ta) y ampliar su aplicación a una gama más amplia de componentes de restauración de implantes (p. ej., tornillos de pilares, pilares personalizados).
- Aleaciones de bajo módulo y alta resistencia: Diseño de aleaciones con nanoestructuras o composiciones de fase especiales para superar las limitaciones tradicionales de resistencia-módulo de las aleaciones convencionales.
7.2 Profunda integración de la fabricación aditiva (impresión 3D) y la odontología digital:
- Estructuras complejas personalizadas: Las tecnologías SLM/EBM pueden fabricar con precisión geometrías complejas que son imposibles con los procesos tradicionales, como implantes personalizados altamente biomiméticos e internamente porosos con estructura en gradiente (que favorecen el crecimiento óseo y la vascularización), pilares personalizados adaptados anatómicamente y andamios de aumento óseo (Membranas GBR, mallas de titanio).
- Optimización de la topología: Mediante algoritmos informáticos, diseño de estructuras de implantes o andamios de restauración con una distribución óptima del material, un peso mínimo y la distribución de tensiones más uniforme basada en el análisis de fuerzas.
- Flujo de trabajo integrado: La impresión 3D se integra perfectamente en los procesos de odontología digital (escaneado oral/adquisición de datos CBCT → diseño CAD → impresión CAM), logrando una fabricación totalmente trazable, eficiente y precisa de restauraciones/guías de implantes/implantes. La reducción de costes y la mejora de la accesibilidad son fundamentales para una adopción más amplia.
7.3 Aplicación de la nanotecnología en la ingeniería de superficies del titanio:
Construcción de nanoestructuras: Mediante métodos químicos (p. ej., grabado ácido doble, tratamiento álcali-calor), físicos (p. ej., ablación láser, haz de iones) o electroquímicos (p. ej., anodización), se construyen con precisión nanotubos, nanoporos, nanopartículas, nanorrugas y otras nanoestructuras en superficies de titanio. Estas características a nanoescala imitan con mayor eficacia la matriz extracelular (MEC), regulando directamente los comportamientos celulares (osteoblastos, células madre), como la adhesión, la propagación, la migración, la proliferación y la diferenciación, e incluso influyendo en la expresión génica.
Nanorrevestimientos funcionalizados:
Recubrimientos antibacterianos: Cargar agentes antibacterianos como nanopartículas de plata (AgNPs), nanopartículas de óxido de zinc (ZnO NPs), péptidos antimicrobianos (AMPs), quitosano, etc., para impartir propiedades antibacterianas duraderas a la superficie y prevenir activamente la periimplantitis.
Recubrimientos promotores osteogénicos/angiogénicos: Cargan factores de crecimiento (p. ej., BMP-2, VEGF), iones bioactivos (p. ej., Sr²⁺, Mg²⁺, Li⁺) o fármacos de molécula pequeña para regular con precisión el microentorno local, promoviendo una regeneración ósea y una vascularización rápidas y de alta calidad.
Recubrimientos sensibles inteligentes: Diseñar recubrimientos inteligentes que respondan a los cambios en el entorno bucal (como la caída del pH o la activación de enzimas bacterianas) para liberar fármacos antibacterianos o antiinflamatorios para el tratamiento a demanda.
Mejora de la estabilidad superficial a largo plazo: Estudiar la estabilidad, el comportamiento de degradación y la respuesta biológica de las nanoestructuras durante el servicio a largo plazo.
Conclusión
El titanio y las aleaciones de titanio se han consolidado en la odontología moderna, especialmente en la implantología dental, debido a su incomparable biocompatibilidad, sus excelentes propiedades mecánicas (en particular, su elevada relación resistencia-peso), su extraordinaria resistencia a la corrosión y su capacidad única para favorecer la osteointegración. Desde los implantes que sirven como raíces dentales artificiales hasta los pilares de conexión y transición, pasando por los andamios de soporte y las eficaces herramientas de ortodoncia, los materiales de titanio atraviesan todos los aspectos de la restauración dental, avanzando enormemente en la reconstrucción de la función oral y la restauración estética.
A pesar de problemas como el coste, las alergias poco frecuentes y la corrosión en entornos de metales mixtos, los avances en la ciencia de los materiales y la tecnología de fabricación siguen abriendo nuevas vías. Las nuevas aleaciones basadas en titanio (como las aleaciones Ti-Zr de alta resistencia y las aleaciones de bajo módulo de tipo β) pretenden mejorar el rendimiento al tiempo que garantizan la bioseguridad; la fabricación aditiva (impresión 3D) ha dado paso a una nueva era de restauraciones e implantes altamente personalizados y de estructura compleja; y la ingeniería de superficies nanoestructuradas permite una precisión sin precedentes en el control de la interfaz material-biológica, dotando a las superficies de titanio de funciones antibacterianas, osteogénicas e incluso de respuesta inteligente.
De cara al futuro, los materiales basados en titanio seguirán siendo el "patrón oro" y un portador de innovación clave en la restauración de implantes dentales. Gracias a la continua innovación de los materiales, los procesos de fabricación avanzados y el diseño preciso de las superficies, la aplicación del titanio en odontología pasará a ser más mínimamente invasiva, más rápida, más duradera, más personalizada y más segura, proporcionando en última instancia a los pacientes soluciones de restauración bucal que sobresalgan tanto en función como en estética, con un mejor pronóstico a largo plazo, mejorando significativamente la calidad de vida de los pacientes. La legendaria historia del titanio en la medicina oral dista mucho de haber terminado y sigue escribiendo nuevos y brillantes capítulos.
Referencias
Brånemark, P. I., Adell, R., Breine, U., Hansson, B. O., Lindström, J., & Ohlsson, A. (1977). Anclaje intraóseo de prótesis dentales. I. Estudios experimentales. Revista Escandinava de Cirugía Plástica y Reparadora, 11(3), 81-100.
(Introdujo el concepto de osteointegración y estableció el fundamento biológico de los implantes de titanio).
ASTM Internacional. (2019). ASTM F67-13: Especificación estándar para titanio no aleado para aplicaciones de implantes quirúrgicos.. ASTM.
ASTM Internacional. (2020). ASTM F136-13: Especificación estándar para la aleación de titanio forjado-6aluminio-4vanadio ELI para aplicaciones de implantes quirúrgicos.. ASTM.
(Define las normas de calidad médica para el titanio comercialmente puro y la aleación Ti-6Al-4V).
Buser, D., Broggini, N., Wieland, M., et al. (2004). Enhanced bone apposition to a chemically modified SLA titanium surface. Revista de Investigación Dental, 83(7), 529-533.
(Estudio clásico que demuestra la osteointegración acelerada mediante la modificación de la superficie SLA).
Chiapasco, M., Casentini, P., & Zaniboni, M. (2012). Procedimientos de aumento óseo en implantología. Revista Internacional de Implantes Orales y Maxilofaciales, 27(Suppl), s183-s203.
(Datos clínicos sobre el uso de la aleación Ti-15Zr (Roxolid®) en implantes de diámetro estrecho).
Kuroda, D., Niinomi, M., Morinaga, M., et al. (1998). Design and mechanical properties of new β type titanium alloys for implant materials. Ciencia e Ingeniería de Materiales: A, 243(1-2), 244-249.
(Demuestra las ventajas biomecánicas de las aleaciones de titanio tipo β de bajo módulo elástico).
Van Noort, R. (2012). El futuro de los dispositivos dentales es digital. Materiales dentales, 28(1), 3-12.
(Analiza las perspectivas de tecnologías de fabricación digital como la impresión 3D para implantes dentales).
Mendonça, G., Mendonça, D. B., Aragão, F. J., & Cooper, L. F. (2008). Advancing dental implant surface technology-From micron-to nanotopography. Biomateriales, 29(28), 3822-3835.
(Analiza cómo las topografías superficiales a nanoescala modulan el comportamiento celular).
Siddiqi, A., Payne, A. G., De Silva, R. K., & Duncan, W. J. (2011). Titanium allergy: A literature review. Revista Internacional de Implantes Orales y Maxilofaciales, 26(4), 743-750.
(Revisión sistemática sobre epidemiología de la alergia al titanio y retos diagnósticos).
Reclaru, L., & Meyer, J. M. (1994). Corrosión electroquímica en odontología restauradora. Clínicas Dentales de Norteamérica, 38(2), 319-332.
(Explora los mecanismos de corrosión electroquímica en el medio bucal con múltiples metales).
Pjetursson, B. E., Thoma, D., Jung, R., et al. (2012). A systematic review of the survival and complication rates of implant-supported fixed dental prostheses (FDPs) after a mean observation period of at least 5 years. Investigación clínica sobre implantes orales, 23(Suppl 6), 22-38.
(Proporciona datos basados en pruebas sobre las tasas de supervivencia de los implantes a lo largo de 10 años).